


세상에서 가장 아름다운 영국의 감동 실화(6분 29초)


• 물리적 변화와 화학적 변화를 설명할 수 있다.
• 물질의 변화를 화학 반응식으로 나타낼 수 있다.
![]()

그림 I-26 물리적 변화의 예

그림 I-27 화학적 변화의 예
![]()
• 물리적 변화
예 - 상태 변화(승화, 응고, 액화, 기화, 융해), 용해, 열팽창, 확산
• 화학적 변화
예 - 산염기 반응, 연소 반응, 산화·환원 반응, 열분해 반응, 전기분해 반응

8. 다음을 물리적 변화와 화학적 변화로 구분하여 보자
1) 기름이 탄다.
2) 고기가 썩는다.
3) 설탕이 물에 녹는다

![]()
• aq: 수용액(aqueous) 상태 , ℓ: 액체(liquid) 상태,
• g: 기체(gas) 상태 s: 고체(solid) 상태
• 이온 반응식에서 aq는 수용액 속에서 물질이 이온 상태로 존재함을 의미하고, s는 앙금 이 되어물에 녹지 않고 가라앉음을 의미한다.
![]()
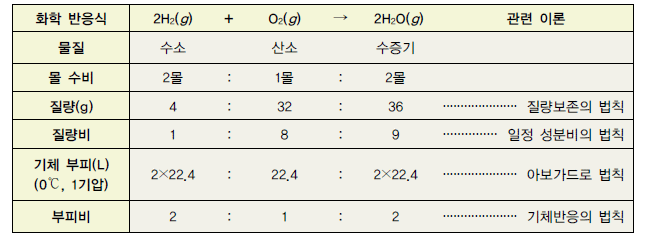
화학 반응식의 계수와 아래 첨자
• 화학식 앞의 계수 : 해당 화합물의 개수
예) 2H - 수소 원자 2개, 3H2 - 수소 분자 3개
• 아래 첨자 : 화합물을 구성하는 원자의 개수
예) H2O - 수소 원자 2개, 산소 원자 1개, Fe2O3 - 철 원자 2개, 산소 원자 3개
![]()
• 엔탈피[enthalpy, H]
어떤 물질이 일정한 압력하에서 생성되는 동안, 그 물질 속에 축적된 열함량을 그 물질의 열함량 또는 엔탈피라 한다.
• 반응 엔탈피(ΔH)
화학반응이 일어나는 반응계에서의 엔탈피 변화
발열반응 : H < 0 , 흡열반응 : H > 0
• 반응열(Q)
화학반응이 일어나는 반응계 주변에서의 에너지(E) 변화
발열반응 : Q > 0, 흡열반응 : Q < 0

9. 다음 반응을 화학 반응식으로 나타내어 보시오.(단, 상태를 표시할 것)
1) 에틴(C2H2)의 연소 반응
2) 염산(HCl)과 수산화나트륨(NaOH) 수용액이 중화되는 반응
3) 1mol의 에탄올(C2H5OH)이 완전 연소할 때 이산화 탄소(CO2)와 물(H2O)이 생 성되면서 1371kJ의 열이 발생하는 반응
| 반응 물질과 생성 물질, ‘+’와 ‘-’를 이용하여 반응식을 나타낸다. | C3H8 + O2 → CO2 + H2O |
|
a, b, c, d 등을 이용하여 계수를 나타낸다. |
aC3H8 + bO2 → cCO2 + dH2O |
|
반응 물질과 생성 물질의 C, H, O의 원자 수가 같아지도록 관 계식을 세운다. |
C의 원자수 : 3a = c H의 원자수 : 8a = 2d O의 원자수 : 2b = 2c + d a=1로 놓고 풀면, 계수 c는 3. d는 4. b는 5 |
|
계수를 정수로 만들고, 물질의 상태를 표시한다. |
C3H8 + 5O2 → 3CO2 + 4H2O |

10. 다음 화학 반응식을 완결하시오
1) aNaCl + bO2 + cH2O + dO2 → eNa2SO4 + fHCl
2) xCu + yHNO3 → zCu(NO3)2 + uH2O + vNO
 0℃, 1기압에서 1.4g의 질소(N2) 기체가 충분한 양의 수소(H2) 기체와 완전히 반응하여 암모니아(NH3) 기체를 생성할 때 반응한 H2의 질량(g)과 생성되는 NH3의 질량(g)을 구해 보자.(단, 원자량은 H가 1.0, N은 14.0이다.)
0℃, 1기압에서 1.4g의 질소(N2) 기체가 충분한 양의 수소(H2) 기체와 완전히 반응하여 암모니아(NH3) 기체를 생성할 때 반응한 H2의 질량(g)과 생성되는 NH3의 질량(g)을 구해 보자.(단, 원자량은 H가 1.0, N은 14.0이다.)


11. 글루코오스(C6H12O6) 1.0g이 충분한 산소와 반응할 때 만들어지는 물의 양을 구해 보 자.
 0℃, 1기압에서 질소(N2) 기체 10.0L가 충분한 양의 수소(H2) 기체와 완전히 반응할 때 생성되는 암모니아(NH3) 기체의 부피(L)를 구해 보자.
0℃, 1기압에서 질소(N2) 기체 10.0L가 충분한 양의 수소(H2) 기체와 완전히 반응할 때 생성되는 암모니아(NH3) 기체의 부피(L)를 구해 보자.


12. 0.5몰의 CaC2(s)가 충분한 양의 물(H2O)과 반응하였을 때 아세틸렌(C2H2) 기체는 표 준 상태에서 몇 L가 생성되었는가?(단, 표준 상태에서 기체 1몰의 부피는 22.4L이다.)
CaC2(s) + 2H2O(ℓ) → Ca(OH)2(aq) + C2H2(g )
 0℃, 1기압에서 프로페인(C3H8) 22.0g을 완전 연소시킬 때, 생성되는 이산화 탄소의 부피를 구해 보자.
0℃, 1기압에서 프로페인(C3H8) 22.0g을 완전 연소시킬 때, 생성되는 이산화 탄소의 부피를 구해 보자.


13. 표준 상태에서 암모니아(NH3) 52g을 합성하는 데 필요한 질소(N2)는 몇 L일까?(단, 표 준 상태에서 기체 1몰의 부피는 22.4L이고, NH3의 분자량은 17이다.)